漢氏聯(lián)合干細(xì)胞新藥獲國(guó)家藥監(jiān)局正式受理
9月26日,漢氏聯(lián)合旗下子公司自主研發(fā)的注射用生物制品,1類新藥“注射用間充質(zhì)干細(xì)胞(臍帶)”收到國(guó)家藥品監(jiān)督管理局核準(zhǔn)簽發(fā)的《受理通知書》,正式被國(guó)家藥品監(jiān)督管理局注冊(cè)受理。
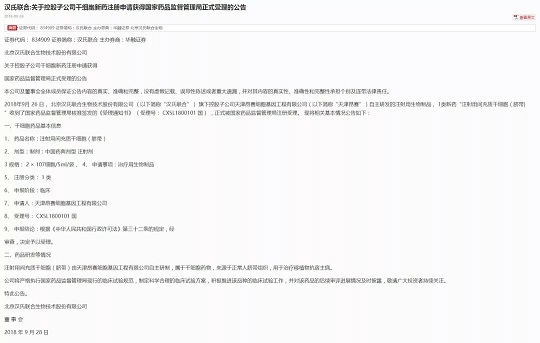
漢氏聯(lián)合:關(guān)于控股子公司干細(xì)胞新藥注冊(cè)申請(qǐng)獲得國(guó)家藥品監(jiān)督管理局正式受理的公告
2018年9月26日,北京漢氏聯(lián)合生物技術(shù)股份有限公司(以下簡(jiǎn)稱“漢氏聯(lián)合”)旗下控股子公司天津昂賽細(xì)胞基因工程有限公司(以下簡(jiǎn)稱“天津昂賽”)自主研發(fā)的注射用生物制品,1類新藥“注射用間充質(zhì)干細(xì)胞(臍帶)”收到了國(guó)家藥品監(jiān)督管理局核準(zhǔn)簽發(fā)的《受理通知書》(受理號(hào):CXSL1800101國(guó)),正式被國(guó)家藥品監(jiān)督管理局注冊(cè)受理。
現(xiàn)將相關(guān)基本情況公告如下:
一、干細(xì)胞藥品基本信息
1、藥品名稱:注射用間充質(zhì)干細(xì)胞(臍帶)
2、劑型:制劑:中國(guó)藥典劑型注射劑
3、規(guī)格:2×10^7細(xì)胞/5ml/袋
4、申請(qǐng)事項(xiàng):治療用生物制品
5、注冊(cè)分類:1類
6、申報(bào)階段:臨床
7、申請(qǐng)人:天津昂賽細(xì)胞基因工程有限公司
8、受理號(hào):CXSL1800101國(guó)
9、申報(bào)結(jié)論:根據(jù)《中華人民共和國(guó)行政許可法》第三十二條的規(guī)定,經(jīng)審查,決定予以受理。
二、藥品研發(fā)等情況
注射用間充質(zhì)干細(xì)胞(臍帶)由天津昂賽細(xì)胞基因工程有限公司自主研制,屬于干細(xì)胞藥物,來源于正常人臍帶組織,用于治療移植物抗宿主病。
公司將嚴(yán)格執(zhí)行國(guó)家藥品監(jiān)督管理局現(xiàn)行的臨床試驗(yàn)規(guī)范,制定科學(xué)合理的臨床試驗(yàn)方案,積極推進(jìn)該品種的臨床試驗(yàn)工作,并對(duì)該藥品的后續(xù)審評(píng)進(jìn)展情況及時(shí)披露。
特此公告
該信息披露引起制藥行業(yè)和普通大眾的強(qiáng)烈關(guān)注。這一利好信息對(duì)我國(guó)醫(yī)藥健康行業(yè)有什么意義?對(duì)普通大眾會(huì)產(chǎn)生什么影響?
下面我們從三個(gè)層面來進(jìn)行闡述:
一、國(guó)外干細(xì)胞藥物狀況
全球干細(xì)胞醫(yī)療市場(chǎng)規(guī)模已從2010年的215億美元,增至2015年的635億美元。預(yù)計(jì)到2018年,全球干細(xì)胞醫(yī)療市場(chǎng)將超過千億美元,達(dá)到1195億美元。國(guó)際知名咨詢公司Technavio發(fā)布了《全球細(xì)胞治療市場(chǎng)2017-2021》,報(bào)告指出,在2017年至2021年期間,全球細(xì)胞治療市場(chǎng)預(yù)計(jì)以23.27%的復(fù)合年增長(zhǎng)率增長(zhǎng)。
2015年我國(guó)干細(xì)胞相關(guān)產(chǎn)業(yè)規(guī)模達(dá)到300億,并維持在50%以上的高復(fù)合增長(zhǎng);預(yù)計(jì)到2021年,我國(guó)干細(xì)胞相關(guān)市場(chǎng)規(guī)模將接近1500億元。
目前,全世界各國(guó)批準(zhǔn)上市的干細(xì)胞產(chǎn)品已有14種,絕大多數(shù)為間充質(zhì)干細(xì)胞產(chǎn)品。
數(shù)據(jù)來源:中國(guó)產(chǎn)業(yè)信息網(wǎng)
二、我國(guó)干細(xì)胞新藥研發(fā)狀況
中國(guó)目前尚無一款干細(xì)胞產(chǎn)品獲批上市。為了趕超干細(xì)胞新藥領(lǐng)域世界發(fā)達(dá)水平,2017年10月26日,國(guó)家食品藥品監(jiān)督管理總局貫徹落實(shí)中共中央辦公廳、國(guó)務(wù)院辦公廳《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(廳字〔2017〕42號(hào))和《國(guó)務(wù)院關(guān)于改革藥品醫(yī)療器械審評(píng)審批制度的意見》(國(guó)發(fā)〔2015〕44號(hào)),組織對(duì)《藥品注冊(cè)管理辦法》進(jìn)行了修訂,起草了《藥品注冊(cè)管理辦法(修訂稿)》,重申:細(xì)胞治療類產(chǎn)品可以按藥報(bào)!
CFDA藥物審批流程極其嚴(yán)格,而且生物醫(yī)藥市場(chǎng)瞬息萬變,各種不確定因素非常之大,因此,生物藥品研發(fā)是一項(xiàng)開發(fā)周期長(zhǎng)、資金投入大、不可預(yù)測(cè)因素多的系統(tǒng)工程,具有較高的風(fēng)險(xiǎn)性!
在首席科學(xué)家韓忠朝院士的帶領(lǐng)下,漢氏聯(lián)合一直處于干細(xì)胞新藥研發(fā)領(lǐng)域的領(lǐng)軍地位,正在積極開發(fā)多款針對(duì)多種疑難病的1類干細(xì)胞新藥。“細(xì)胞治療類產(chǎn)品可以按藥報(bào)”的利好政策一公布,漢氏聯(lián)合就開始積極籌備干細(xì)胞新藥申報(bào)的遞交材料。
漢氏聯(lián)合擁有一系列干細(xì)胞分離技術(shù)專利,保障干細(xì)胞安全存儲(chǔ),為后續(xù)干細(xì)胞臨床大范圍應(yīng)用提供穩(wěn)定性和安全性保障。
三、“注射用間充質(zhì)干細(xì)胞(臍帶)”與國(guó)外新藥的差別
在國(guó)際上,多數(shù)干細(xì)胞產(chǎn)品是自體干細(xì)胞應(yīng)用的醫(yī)療技術(shù)服務(wù)。異體來源干細(xì)胞藥品主要是成人骨髓和脂肪來源的間充質(zhì)干細(xì)胞,例如,澳大利亞OsirisTherapeutic公司生產(chǎn)的間充質(zhì)干細(xì)胞產(chǎn)品Prochymal來自異體成人骨髓,用于治療移植物抗宿主病;比利時(shí)TiGenix公司生產(chǎn)的間充質(zhì)干細(xì)胞Cx601來自異體成人脂肪,用于治療克羅恩病并發(fā)復(fù)雜肛瘺。
然而,成人組織來源的干細(xì)胞存在一些顯著的局限性,如干細(xì)胞數(shù)量及增殖分化潛能隨供者年齡的增大而下降,病毒感染率較高,采集量有限且易對(duì)供者造成損傷(通常需進(jìn)行抽吸骨髓、脂肪等有創(chuàng)性操作),難以進(jìn)行標(biāo)準(zhǔn)化制備。
與成體干細(xì)胞相比,圍產(chǎn)期臍帶和胎盤干細(xì)胞具有明顯的優(yōu)勢(shì),主要包括:增殖分化能力強(qiáng)、免疫原性低、基因穩(wěn)定性好、無倫理障礙、數(shù)量豐富等。
漢氏聯(lián)合將持續(xù)努力推動(dòng)祖國(guó)干細(xì)胞再生醫(yī)學(xué)發(fā)展,必將開發(fā)出越來越多令世人矚目的創(chuàng)新性干細(xì)胞產(chǎn)品,讓更多人能夠利用新型的醫(yī)療科技實(shí)現(xiàn)健康中國(guó)的夢(mèng)想!


