【中國醫(yī)藥報(bào)】逆轉(zhuǎn)生命的時(shí)鐘
——2012年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)解讀
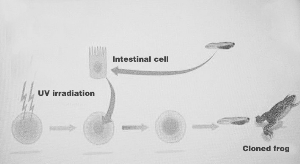
獲得克隆蛙示意圖。
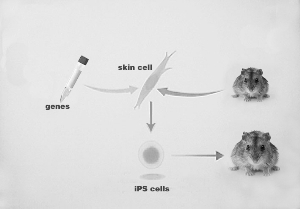
獲得iPS細(xì)胞示意圖。
英國科學(xué)家約翰·格登在青蛙的卵與體細(xì)胞之間轉(zhuǎn)換DNA,培育出世界上第一只“克隆”蛙;日本科學(xué)家山中伸彌基于約翰·格登的理念,將普通皮膚重新 變回多能干細(xì)胞……79歲的約翰·戈登、50歲的山中伸彌,兩位學(xué)者因在細(xì)胞核重編程研究領(lǐng)域的杰出貢獻(xiàn),獲得2012年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。他們的重 大貢獻(xiàn)在于從理論上顛覆了人們對(duì)自然發(fā)育分化的傳統(tǒng)觀念,即認(rèn)為干細(xì)胞分化為體細(xì)胞是不可逆的過程,從而為獲取多能干細(xì)胞增添了一個(gè)新的途徑。而以此為核 心技術(shù)的再生醫(yī)學(xué)研究也將得以快速的發(fā)展,人類逆轉(zhuǎn)生命的時(shí)鐘,實(shí)現(xiàn)生命的再造不再是遙不可及的夢(mèng)想。
精彩的貢獻(xiàn)
“今年的諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)?lì)C給了從事干細(xì)胞研究的科學(xué)家,這對(duì)從事干細(xì)胞研究的人來說是一件喜事,也說明了干細(xì)胞研究的重要性。”中國醫(yī)學(xué)科學(xué)院血液學(xué)研究所、國家干細(xì)胞工程技術(shù)研究中心主任韓忠朝教授如是說。
“其實(shí),約翰·格登和山中伸彌的獲獎(jiǎng)在預(yù)料之中,可謂實(shí)至名歸。”中國科學(xué)院廣州生物醫(yī)藥與健康研究院潘光錦研究員如是說。
“所謂細(xì)胞核重編程,就是將已經(jīng)分化了的成年體細(xì)胞進(jìn)行誘導(dǎo),讓其重新回到發(fā)育早期多能干細(xì)胞狀態(tài),重新獲得發(fā)育成各種類型細(xì)胞的能力。”潘光錦解 釋說,按照對(duì)生命孕育、生長(zhǎng)和成熟的傳統(tǒng)看法,在生殖細(xì)胞配子(精子和卵子)結(jié)合形成胚胎的孕育之初,胚胎中的所有細(xì)胞都是不成熟的細(xì)胞,它們可以分化發(fā) 育為身體的各種器官和組織。例如,從胚胎細(xì)胞可以分化為神經(jīng)細(xì)胞,再生成大腦、脊髓和周圍神經(jīng),形成神經(jīng)系統(tǒng)。但是,它們形成之后,就成為定性、定型的特 化細(xì)胞。當(dāng)這些神經(jīng)細(xì)胞、肝細(xì)胞等特化成熟后,就不能逆轉(zhuǎn)回到過去的非成熟細(xì)胞,即意味著生命是不可以逆轉(zhuǎn)的。然而,約翰·格登和山中伸彌的研究卻打破了 這一固有觀念,發(fā)現(xiàn)成熟細(xì)胞可以逆轉(zhuǎn)回原始狀態(tài),被重編程為多功能的干細(xì)胞。他們的精彩成果徹底改變了人類對(duì)細(xì)胞和生物體發(fā)展的認(rèn)識(shí),關(guān)于細(xì)胞命運(yùn)調(diào)控和 發(fā)育的教科書內(nèi)容已經(jīng)被重新改寫。
除此之外,韓忠朝認(rèn)為,約翰·格登和山中伸彌的突出貢獻(xiàn)還在于其免除了使用人體胚胎提取干細(xì)胞的倫理道德制約。細(xì)胞是構(gòu)成人體組織器官的基本單位, 人體大約由200多種類型的60萬億個(gè)細(xì)胞構(gòu)成。在人的一生中,身體內(nèi)各種細(xì)胞需要不斷地更新,而這些新陳代謝的任務(wù)就是由一類特殊的細(xì)胞——干細(xì)胞來完 成。胚胎干細(xì)胞是最原始的干細(xì)胞,能分化成人體各個(gè)組織的各種細(xì)胞,因此具有重大的科學(xué)研究?jī)r(jià)值和臨床應(yīng)用前景。但是,用傳統(tǒng)技術(shù)來分離人胚胎干細(xì)胞需要 破壞人的胚胎,從而面臨著嚴(yán)重的倫理學(xué)挑戰(zhàn)。一些倫理學(xué)要求嚴(yán)格的國家甚至禁止人胚胎干細(xì)胞的研究。他們兩人分別采用不同的方法使細(xì)胞重編程,使終末分化 成熟的細(xì)胞變回為多潛能的原始干細(xì)胞,實(shí)現(xiàn)了成熟細(xì)胞的“返老還童”。這種通過不破壞人胚胎的方法獲取胚胎干細(xì)胞,為科學(xué)研究和臨床應(yīng)用提供了不違背倫理 道德的途徑。
在此次獲得諾獎(jiǎng)之前,他們的研究成果幾乎包攬了拉斯克基礎(chǔ)醫(yī)學(xué)獎(jiǎng)、沃爾夫醫(yī)學(xué)獎(jiǎng)等所有醫(yī)學(xué)界大獎(jiǎng)。“我們很驚奇地發(fā)現(xiàn),諾貝爾醫(yī)學(xué)或生理學(xué)獎(jiǎng)也開始 不計(jì)較時(shí)間的考驗(yàn)而提前頒發(fā)了。山中伸彌從2006年發(fā)表研究成果至今才區(qū)區(qū)6年,迄今尚未證明是否最后能用于人體治療。但這在一個(gè)側(cè)面也說明了這項(xiàng)研究 的巨大貢獻(xiàn)。”韓忠朝對(duì)記者說。
重大的價(jià)值
潘光錦介紹,早在上世紀(jì)50年代,約翰·格登就向分化細(xì)胞的不可逆性發(fā)出了挑戰(zhàn),在一個(gè)經(jīng)典的青蛙實(shí)驗(yàn)中發(fā)現(xiàn)了“細(xì)胞的特化是可逆的”這一顛覆性的 結(jié)論:他用來自蝌蚪腸道的成熟分化細(xì)胞的細(xì)胞核替換掉了卵細(xì)胞內(nèi)不成熟的細(xì)胞核,這一修改后的卵細(xì)胞最終仍發(fā)育成一只正常的蝌蚪。蝌蚪分化細(xì)胞的細(xì)胞核在 移植進(jìn)入卵母細(xì)胞質(zhì)中后,能指導(dǎo)卵細(xì)胞發(fā)育為性成熟的成體青蛙。“這是世界上首次證明成熟的細(xì)胞核在一定情況下可以逆轉(zhuǎn)為原始狀態(tài)。”約翰·格登在實(shí)驗(yàn)中 所使用的體細(xì)胞核移植技術(shù)通常被稱為克隆技術(shù)。潘光錦說,隨后,這一發(fā)現(xiàn)又在其他的動(dòng)物實(shí)驗(yàn)中得到了證實(shí)。而哺乳動(dòng)物體細(xì)胞核移植的首次成功,則是大家所 熟悉的克隆羊“多利”的誕生。
約翰·格登的發(fā)現(xiàn)是一個(gè)革命性的改變,理論價(jià)值很大,無數(shù)實(shí)驗(yàn)室的工作都構(gòu)建在他這項(xiàng)開創(chuàng)性的研究之上。“但這一發(fā)現(xiàn)的實(shí)用性卻顯得不足,這是因?yàn)?細(xì)胞核移植不僅煩瑣和復(fù)雜,難度高,成功率低,而且由于需要提供卵細(xì)胞,還存在倫理問題。”潘光錦暢談道:“40多年后,山中伸彌進(jìn)一步彌補(bǔ)了這些缺憾, 神奇的研究重新驗(yàn)證并深化了格登的發(fā)現(xiàn)。”
2006年,山中伸彌等在對(duì)24個(gè)胚胎干細(xì)胞高表達(dá)的候選基因進(jìn)行篩選后,最終確定了Oct3/4、Sox2、c-Myc、Klf4起關(guān)鍵作用的4 個(gè)因子,借助這4個(gè)“引擎”就可以使成熟的體細(xì)胞重編程為多能干細(xì)胞。通過慢病毒載體介導(dǎo),山中伸彌將這4種因子導(dǎo)入小鼠的皮膚細(xì)胞中,最終獲得了具有強(qiáng) 大的自我更新和分化潛能的多能干細(xì)胞,這些能發(fā)育成各種組織的細(xì)胞被命名為誘導(dǎo)多能干細(xì)胞(iPS細(xì)胞)。這一開創(chuàng)性的研究成果發(fā)表于國際知名期刊《細(xì) 胞》上,引起了全世界的轟動(dòng)。
“當(dāng)時(shí)有人認(rèn)為山中伸彌的成功是運(yùn)氣,是偶然,但卻被越來越多的工作給予證實(shí)。”隨后,他與美國威斯康星大學(xué)詹姆斯·湯姆森博士同時(shí)在在人體細(xì)胞中也完成了這一壯舉。潘光錦介紹,小鼠、人等不同物種iPS細(xì)胞的成功不斷證明了細(xì)胞命運(yùn)是可以通過基因調(diào)節(jié)轉(zhuǎn)換的。
兩位專家表示,約翰·格登和山中伸彌的研究具有重要價(jià)值:其生物學(xué)價(jià)值在于可對(duì)細(xì)胞進(jìn)行人工主動(dòng)調(diào)控和干預(yù),實(shí)現(xiàn)細(xì)胞水平的生命再造,為研究發(fā)育本 身提供了新思路,同時(shí)避免了異體移植產(chǎn)生的免疫排斥反應(yīng),是人類真正進(jìn)入生命再造時(shí)代的開始;其次,其醫(yī)學(xué)價(jià)值也相當(dāng)重要:人體上有眾多的體細(xì)胞,這項(xiàng)技 術(shù)意味著生產(chǎn)人自體干細(xì)胞有了無窮無盡的“原料”,為再生醫(yī)學(xué)的研究應(yīng)用帶來了新的希望。此外,通過iPS細(xì)胞技術(shù)誘導(dǎo)分化成的特定類型的細(xì)胞,還可以作 為藥物篩選的模型,進(jìn)一步保證新藥篩選的成功率。
引領(lǐng)的熱潮
其實(shí)早在1998年,詹姆斯·湯姆森博士領(lǐng)導(dǎo)的小組就在《science》上發(fā)表建立了世界首個(gè)人胚胎干細(xì)胞系的研究成果,由此產(chǎn)生了再生醫(yī)學(xué)的概 念,引起了世界各國對(duì)干細(xì)胞研究的熱潮。曾經(jīng)師從湯姆森博士的潘光錦談到,而基于約翰·格登的開創(chuàng)性工作之后,山中伸彌又掀起了新一輪iPS細(xì)胞的研究熱 潮。6年來,全世界科研人員你追我趕,關(guān)于iPS細(xì)胞的研究成果相繼發(fā)表于眾多世界頂級(jí)學(xué)術(shù)期刊。
“2005年左右,我國也從國家戰(zhàn)略上對(duì)iPS細(xì)胞的研究給予了重視和支持,并有許多重量級(jí)的成果受到世界矚目。”潘光錦談到,2009年,中國科 學(xué)院動(dòng)物研究所周琪研究員在《自然》上報(bào)告首次利用iPS細(xì)胞,通過四倍體囊胚注射得到存活并具有繁殖能力的小鼠,從而在世界上第一次證明了iPS細(xì)胞的 全能性。
中國科學(xué)院廣州生物醫(yī)藥與健康研究院裴端卿研究員發(fā)現(xiàn)了維生素C能夠極大促進(jìn)體細(xì)胞“變身”為iPS細(xì)胞,從而掃除體細(xì)胞“變身”為iPS細(xì)胞的分 子障礙,也發(fā)現(xiàn)了體細(xì)胞變身過中間充質(zhì)表皮細(xì)胞轉(zhuǎn)換的重要作用。這些研究相繼以封面文章發(fā)表在干細(xì)胞頂級(jí)雜志《細(xì)胞-干細(xì)胞》上,引起了國內(nèi)外同行的廣泛 關(guān)注。“此外,其他一些關(guān)于iPS細(xì)胞機(jī)制的研究國內(nèi)也多有貢獻(xiàn),我們?cè)谶@個(gè)研究熱潮中并不落后,且占據(jù)了一席之地。”潘光錦評(píng)價(jià)道。
據(jù)介紹,2011年,我國在iPS細(xì)胞研究領(lǐng)域發(fā)表的論文數(shù)量?jī)H遜于美國和日本,居于世界第三位;但在干細(xì)胞領(lǐng)域發(fā)表論文的總數(shù)量已經(jīng)超過日本躍居世界第二。
專家認(rèn)為,論文的數(shù)量雖然反映我國在這一領(lǐng)域緊跟世界,但是在基礎(chǔ)研究的原創(chuàng)性上仍需努力。潘光錦尤其強(qiáng)調(diào),除了在基礎(chǔ)研究領(lǐng)域,我國的iPS細(xì)胞 研究要走在世界前列,還需要在臨床治療上多下功夫,把眼光從技術(shù)突破延伸到臨床應(yīng)用領(lǐng)域。而且就這一點(diǎn)而言,我們與國外處于同一起跑線上。“我國人群病種 多樣,為研究提供了得天獨(dú)厚的材料,加之患者的依從性較好,國家對(duì)新醫(yī)療技術(shù)也非常支持。”潘光錦表示,目前他們也在開展有關(guān)的工作,希望今后幾年能針對(duì) 退行性病變?nèi)缋夏臧V呆和脊髓損傷等患者進(jìn)行iPS細(xì)胞治療。
應(yīng)用的桎梏
盡管iPS細(xì)胞為再生醫(yī)學(xué)和一些遺傳疾病的治療提供了希望,但韓忠朝強(qiáng)調(diào):當(dāng)前iPS細(xì)胞只是具備了臨床應(yīng)用前景,還沒有在臨床試驗(yàn)中顯示出實(shí)用價(jià)值。
山中伸彌本人是一個(gè)比較嚴(yán)謹(jǐn)?shù)目茖W(xué)家,他充分認(rèn)識(shí)到了iPS細(xì)胞目前的研究狀態(tài),曾說“制造iPS細(xì)胞就像制造癌細(xì)胞”,他也不認(rèn)為iPS細(xì)胞現(xiàn)在 就能取代胚胎干細(xì)胞。因此,韓忠朝提醒,我們?cè)趹c祝干細(xì)胞領(lǐng)域的科學(xué)家獲得諾獎(jiǎng)的同時(shí),也要清晰地認(rèn)識(shí)到iPS細(xì)胞在科學(xué)研究和臨床應(yīng)用方面的局限 性,iPS細(xì)胞技術(shù)還有待時(shí)間的進(jìn)一步驗(yàn)證,這些問題也決定了這項(xiàng)技術(shù)未來的發(fā)展方向。
韓忠朝認(rèn)為,首先是細(xì)胞的安全性問題。最初制備iPS細(xì)胞需要病毒載體的參與,需要向正常細(xì)胞中轉(zhuǎn)入一些原癌基因,這成為iPS細(xì)胞安全性的重大隱患。隨著科學(xué)技術(shù)的不斷發(fā)展,一些不依賴于病毒載體參與的方法得以問世,先后創(chuàng)建了腺病毒載體技術(shù)、蛋白轉(zhuǎn)染技術(shù)、小RNA技術(shù)等一系列非整合重編程技 術(shù),制備iPS細(xì)胞的方法變得越來越安全。期待在不久的將來,沒有病毒、沒有轉(zhuǎn)基因、高效快速獲得iPS細(xì)胞的技術(shù)會(huì)被建立。
另外,iPS細(xì)胞是否真能代替胚胎干細(xì)胞也值得進(jìn)一步研究明確。研究發(fā)現(xiàn),iPS細(xì)胞和胚胎干細(xì)胞在一些我們未曾關(guān)注的方面存在不少差異。例 如,iPS細(xì)胞表現(xiàn)出更糟糕的基因組穩(wěn)定性,這使其在再生醫(yī)學(xué)方面的臨床應(yīng)用安全性受到比胚胎干細(xì)胞更嚴(yán)重的挑戰(zhàn)。韓忠朝提醒,iPS細(xì)胞的機(jī)制還未被完 全闡明。比如,為什么引進(jìn)一些外源的基因,或是小分子物質(zhì),就能夠誘導(dǎo)終末分化的細(xì)胞成為原始的多潛能細(xì)胞?iPS細(xì)胞的原始性和腫瘤細(xì)胞的低分化性是否 存在一定的共同點(diǎn)?此外,許多人認(rèn)為iPS細(xì)胞用于本人不會(huì)產(chǎn)生免疫排異,但不少研究結(jié)果卻發(fā)現(xiàn)并非如此。
在采訪中,潘光錦也表示,iPS細(xì)胞的獲得畢竟是一個(gè)人工過程,其基因組有無發(fā)生改變;通過這一技術(shù)分化出的各種細(xì)胞與人體本身的細(xì)胞是否具有同樣 功能;移植后的細(xì)胞在人體長(zhǎng)期存在是否安全;如何進(jìn)一步提高iPS細(xì)胞的分化效率,并控制其質(zhì)量……“這些都是困擾iPS細(xì)胞技術(shù)的瓶頸,目前國際上也都 處于探索階段,但前景很好”。
iPS細(xì)胞研究還處于實(shí)驗(yàn)室階段,這一領(lǐng)域面臨的挑戰(zhàn)依然很多。潘光錦坦言:“iPS細(xì)胞技術(shù)是再生醫(yī)學(xué)的核心技術(shù),或許還有諸多不成功的因素存 在,但目前看來,iPS細(xì)胞研究具有一切可成功的現(xiàn)象和特征,前景不可限量,以此為依托,我們大有可為,但需要各國科學(xué)家的共同努力。”
(原載于《中國醫(yī)藥報(bào)》 2012-10-16 A06版)


