Cell:潛在毒性蛋白降解調(diào)控新機(jī)制
來源:生物360
機(jī)體的蛋白質(zhì)在失去“使用價(jià)值”后,它會(huì)被細(xì)胞降解為氨基酸,然后再循環(huán)生成新的蛋白。
近日,洛克菲勒大學(xué)霍華德休斯醫(yī)學(xué)研究所(Howard Hughes Medical Institute, The Rockefeller University)的研究人員揭示了細(xì)胞的蛋白質(zhì)回收站——蛋白酶體(proteasome)處理不必要的和潛在毒性蛋白的一條新途徑。這一研究發(fā)現(xiàn) 對(duì)于肌萎縮、神經(jīng)退行性疾病和癌癥等疾病的治療具有重要的意義。相關(guān)論文發(fā)表在4月25日的《細(xì)胞》(Cell)雜志上。
科學(xué)家們一致認(rèn)為,蛋白酶體持久地處于活躍狀態(tài),負(fù)責(zé)破壞超出壽命期的蛋白質(zhì)。越來越多的數(shù)據(jù)表明,蛋白酶體受到動(dòng)態(tài)調(diào)控,尤其當(dāng)細(xì)胞面對(duì)繁重的蛋白質(zhì)周轉(zhuǎn)(protein turnover)時(shí)會(huì)提高它的活性。
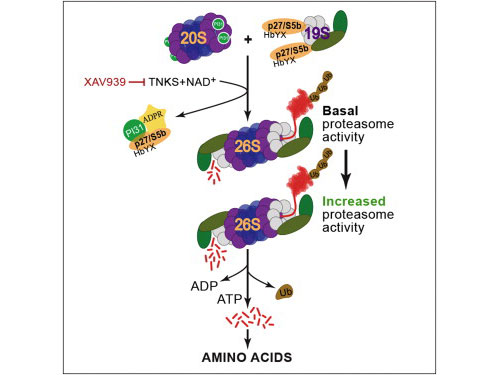
這項(xiàng)最新研究證實(shí)一種稱作TNKS (ADP-ribosyltransferase tankyrase )的酶調(diào)控了蛋白酶體的活性。此外,最初由諾華(Novartis)開發(fā)出來治療結(jié)腸癌的一種小分子XAV939可以抑制TNKS,阻斷蛋白酶體的活性。
研究人員表示,這項(xiàng)研究發(fā)現(xiàn)具有巨大的臨床意義,因?yàn)樗x予了現(xiàn)有的一種小分子化合物新的價(jià)值。尤其是,這種TNKS抑制劑或許可在臨床上用于治療多發(fā)性骨髓瘤。
此前,洛克菲勒大學(xué)的研究人員在上世紀(jì)90年代后期最早鑒別出端錨聚合酶(Tankyrase),證實(shí)其在端粒延伸中發(fā)揮重要的作用。
在一系列的果蠅和人類細(xì)胞實(shí)驗(yàn)中,這項(xiàng)最新研究發(fā)現(xiàn)端錨聚合酶利用了一個(gè)稱作ADP核糖基化(ADP-ribosylation)的過程來修飾PI31。 PI31是對(duì)蛋白酶體活性,以及將蛋白酶體亞單位組裝成稱作26s的活性復(fù)合體起關(guān)鍵調(diào)控作用的一個(gè)因子。通過促進(jìn)組裝出更多的26S顆粒,壓力下的細(xì)胞 可以提高它們分解和處理不必要蛋白質(zhì)的能力。
蛋白酶體是當(dāng)前開發(fā)癌癥治療的一個(gè)靶點(diǎn)。FDA已經(jīng)批準(zhǔn)了蛋白酶體抑制劑萬珂(Velcade)用于治療多發(fā)性骨髓瘤和套細(xì)胞淋巴瘤。然而,接受Velcade治療的患者可能會(huì)經(jīng)受周圍神經(jīng)病變,或是產(chǎn)生耐藥。
多發(fā)性骨髓瘤細(xì)胞需要提高蛋白酶體活性才能生存。來自Cho-Park和Steller的初期數(shù)據(jù)顯示,XAV939能夠在不影響細(xì)胞內(nèi)蛋白酶體基礎(chǔ)水平的情況下,抑制額外的蛋白酶體組裝,從而阻斷多發(fā)性骨髓瘤的生長(zhǎng)。這種選擇性靶向意味著對(duì)患者的副作用較小。
研究人員表示,諸如XAV939這樣的藥物,通過與Velcade不同的機(jī)制來抑制蛋白酶體,具有重要的臨床意義。
這項(xiàng)研究結(jié)果也是第一次將蛋白酶體的代謝與調(diào)控關(guān)聯(lián)起來。有時(shí)候,蛋白酶體消化過多的蛋白,有可能導(dǎo)致肌肉減少。蛋白質(zhì)降解是正常細(xì)胞生物學(xué)極其重要的一個(gè) 過程。新研究發(fā)現(xiàn)提供了對(duì)于這一過程的基本認(rèn)識(shí),并揭示了在肌萎縮和神經(jīng)退變等疾病中的一個(gè)重要因子。有趣的是,這些研究發(fā)現(xiàn)還啟發(fā)了正在進(jìn)行中的癌癥治 療研究,舉例說明了基礎(chǔ)研究對(duì)于藥物開發(fā)的影響。
原文檢索:
Park F. Cho-Park,Hermann Steller. Proteasome Regulation by ADP-Ribosylation. Cell, 25 April 2013; DOI: 10.1016/j.cell.2013.03.040


