漢氏聯(lián)合新藥專輯①:六個干細胞新藥IND獲批
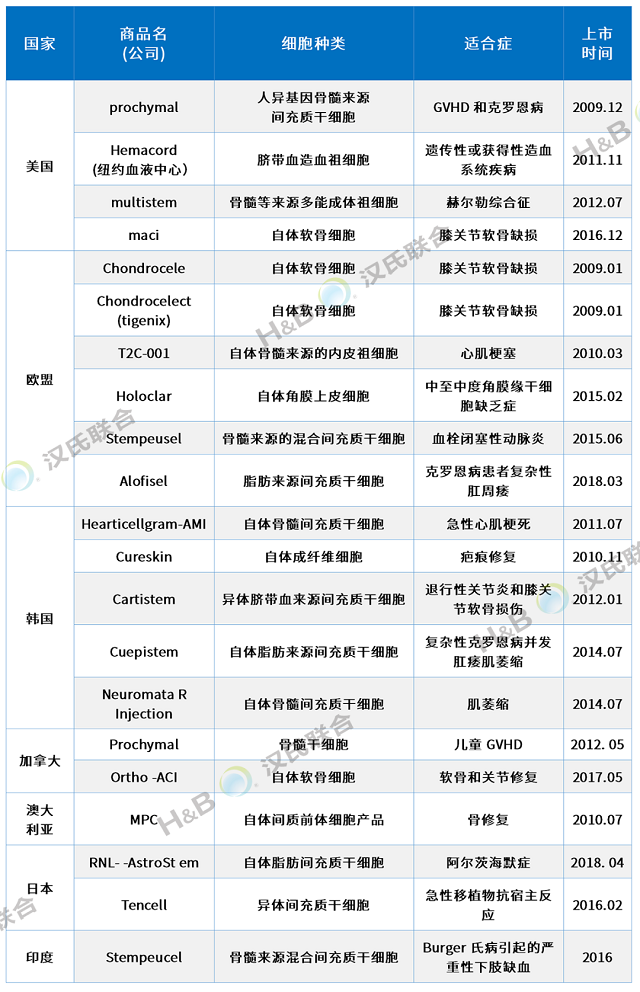
全球21個干細胞藥物上市,適應癥廣泛
截止到2021年6月1日,用“stem cell”作為關鍵詞,在ClinicalTrials.gov網(wǎng)站檢索到8565項登記注冊的干細胞臨床試驗方案。按國家和地區(qū)統(tǒng)計,全球干細胞臨床研究排名前三的國家或地區(qū)分別是美國(4369項)、歐洲(2036項)和中國(709項)。新的研究領域和新方法的推動,以及各國政府政策的支持,促進了干細胞治療的快速發(fā)展。

目前,全球已有21款藥物上市,適應癥包括膝關節(jié)軟骨缺損、移植物抗宿主病、克羅恩病、骨修復、急性心肌梗死、遺傳性或獲得性造血系統(tǒng)疾病、退行性關節(jié)炎和膝關節(jié)軟骨損傷、克羅恩病并發(fā)肛瘺、赫爾勒綜合征、肌萎縮性側索硬化癥、中度至重度角膜緣干細胞缺乏癥、血栓閉塞性動脈炎等疾病。
根據(jù)Polaris Market Research發(fā)布的最新研究報告,2018—2026年全球間充質干細胞市場預計以7.3%的復合年增長率增長。同樣,全球市場調(diào)研機構ARC(AnalyticalResearch Cognizance)發(fā)布的報告也顯示,全球間充質干細胞市場發(fā)展迅速,預計至2024年底其市場值將達到2.2億美元。
國內(nèi)政策明朗,國產(chǎn)干細胞藥物崛起
醫(yī)療機構開展的干細胞臨床研究是由中華人民共和國衛(wèi)生健康委員會和國家藥品監(jiān)督管理局協(xié)同共管,以《中華人民共和國藥品管理法》為法律依據(jù),遵行《干細胞臨床研究管理辦法(試行)》和《干細胞制劑質量控制及臨床前研究指導原則(試行)》,以醫(yī)療機構為主體,實行干細胞臨床研究機構和項目的雙備案。如后續(xù)申請藥品注冊臨床試驗,可將已獲得的臨床研究結果作為技術性申報資料提交并用于藥品評價,按照藥品審批程序進行。
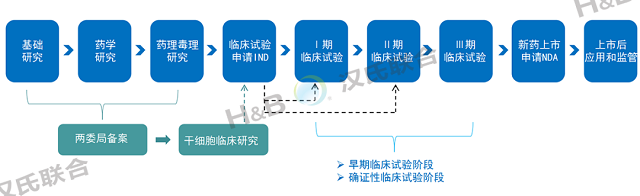
間充質干細胞藥物申報路徑
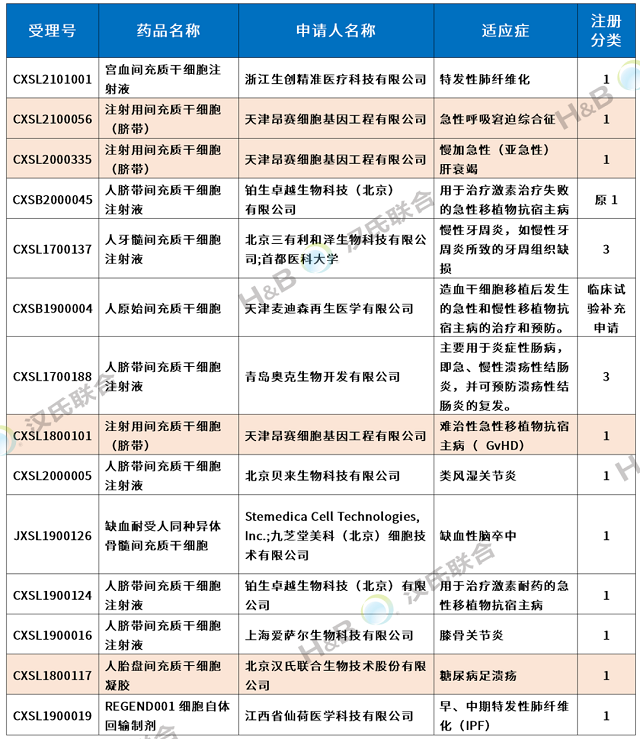
2018年6月至今,國內(nèi)相繼有14款干細胞新藥的IND申請獲國家藥品審評中心(CDE)正式受理,除了REGEND001細胞自體回輸制劑為自體肺基底層上皮細胞外,其它13款均為間充質干細胞。
漢氏聯(lián)合6個新藥IND獲批,國內(nèi)一路領先
2021年4月21日,漢氏聯(lián)合集團旗下子公司天津昂賽細胞基因工程有限公司提報的干細胞1類新藥:注射用間充質干細胞(臍帶)的新藥臨床試驗申請獲得國家藥監(jiān)局藥品審評中心(CDE)默示許可(CXSL2100056)。自此,漢氏聯(lián)合集團共有6個干細胞新藥臨床試驗獲批,其中一個新藥“高活性人臍帶間充質干細胞注射液”I/IIa期臨床試驗獲得法國藥監(jiān)局(ANSM)簽發(fā)許可,用于治療“重度下肢缺血”。
間充質干細胞是細胞治療的明星細胞
根據(jù)《中華人民共和國藥品管理法》第二條關于藥品的定義:本法所稱藥品,是指用于預防、治療、診斷人的疾病,有目的地調(diào)節(jié)人的生理機能并規(guī)定有適應癥或者功能主治、用法和用量的物質,包括中藥、化學藥和生物制品等。藥品直接關系到人們的身體健康甚至生命存亡。因此,其質量不得有半點馬虎,必須確保藥品的安全、有效、均一、穩(wěn)定。
鑒于特殊干細胞及其衍生物是一種全新的生物制品,其生產(chǎn)過程的質量把控,包括純度、穩(wěn)定性和效能的檢測、研究人員的技術操作等,直接關系到試驗的風險和受試者的安全;與化藥相比,具有活性的細胞制品要保證其均一穩(wěn)定性,則需要更全面監(jiān)測手段,更嚴謹?shù)墓ぷ髁鞒蹋约案€(wěn)妥的物流運輸做保障。
1. 間充質干細胞的安全性
2012年韓忠朝院士團隊在《Stem Cells International》雜志上發(fā)表綜述“Safety of Mesenchymal Stem Cells for Clinical Application”,表明臍帶間充質干細胞沒有成瘤的風險,并且間充質干細胞在裸鼠等動物上應用無致敏性和沒有明顯毒性。

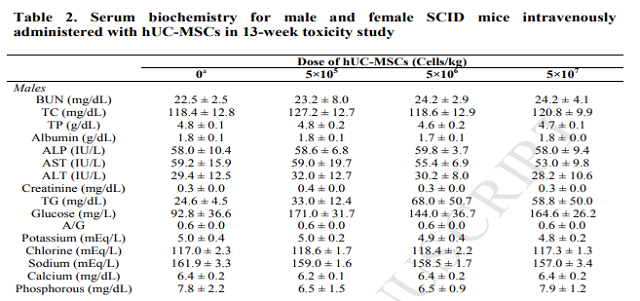
韓國學者用人臍帶來源的間充質干細胞在急性肝損傷中的作用。分別設定高劑量組(5×10^7個/kg ),中劑量組(5×10^6個/kg),低劑量組(5X10^5個/kg)和空白對照組,歷經(jīng)13周后,在體重,血清生化、尿檢、血液學檢測、器官重量上沒有顯著的變化;
將臍帶間充質干細胞靜脈注射入C57BL/6鼠體內(nèi),其致瘤性實驗結果顯示:歷經(jīng)26周后,陽性對照組100%長瘤,陰性對照組和實驗組均無長瘤,說明臍帶間充質干細胞無致瘤性。
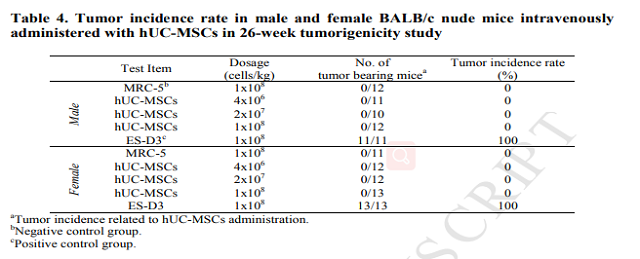
特別是移植13周后,小鼠主要器官中hUC-MSCs未被檢測到,也沒有發(fā)現(xiàn)全身性毒性或腫瘤。綜上所述,這些結果表明hUC-MSCs在未來的臨床治療疾病具有很大的潛力。
2. 均一性、穩(wěn)定性的間充質干細胞
間充質干細胞的質控體系,貫穿于細胞生產(chǎn)工藝的每個環(huán)節(jié),包括組織采集,細胞分離、擴增、收獲,以及產(chǎn)品放行。每個生產(chǎn)環(huán)節(jié),都需要相應的質量控制方法和標準。國家衛(wèi)健委明確規(guī)定: 通過中國食品藥品檢定研究院檢定的干細胞產(chǎn)品才能用于臨床疾病治療研究。
漢氏聯(lián)合自主研發(fā)的胎盤和臍帶間充質干細胞產(chǎn)品,均已通過了中國食品藥品檢定研究院檢定。漢氏聯(lián)合集團旗下子公司天津昂賽細胞基因工程有限公司細胞檢測實驗室獲得中國合格評定國家認可委員會(CNAS)頒發(fā)的細胞檢測國家實驗室認可證書,證書號:CNASL11892,標志著公司細胞檢測實驗室具備國家及國際認可的管理水平和檢測能力。CNAS細胞檢測實驗室所提供的檢驗報告國際同行認可,出具的檢驗報告可得到全球100多個國家和地區(qū)的檢測結果互認。

在國家利好政策前提下,我國科學研究者積極研發(fā)與探索,相信不久將來我國將迎來首個本土干細胞藥物。


