Cell:揭開白血病細(xì)胞生存的秘密
日前,紐約大學(xué)醫(yī)學(xué)院等研究機(jī)構(gòu)開展的一項最新研究發(fā)現(xiàn)了白血病細(xì)胞生存的秘密:一個遺傳突變推動了白血病細(xì)胞。這項研究不僅解答了一個進(jìn)化謎題,并為開發(fā)出高度靶向的白血病治療鋪平了道路。
在這項刊登在《細(xì)胞》(Cell)雜志上的研究中,紐約大學(xué)Langone醫(yī)學(xué)中心的研究人員描述了,突變蛋白 Fbxw7 在癌細(xì)胞和健康細(xì)胞中表達(dá)時的行為差異。
研究人員表示,F(xiàn)bxw7 是血細(xì)胞生成的必要條件。而為何一個對于生存如此重要的基因上會持續(xù)存在一種突變?這是一個大的謎題。這項研究發(fā)現(xiàn),這一突變會影響癌細(xì)胞,但卻對健康細(xì)胞沒有影響。
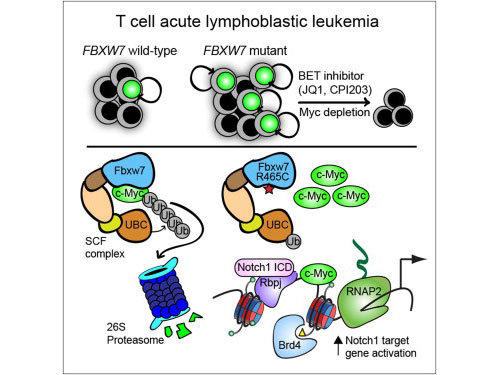
Fbxw7 蛋白調(diào)控了造血干細(xì)胞的生成,后者是可以分化為所有類型血細(xì)胞的前體細(xì)胞。沒有 Fbxw7 ,機(jī)體會喪失造血能力,最終患上貧血。科學(xué)家們還只是剛開始了解突變 Fbxw7 出現(xiàn)在相當(dāng)一部分人類腫瘤,包括胃癌、前列腺癌和一些乳腺癌中的原因。這一突變尤其普遍存在于T細(xì)胞急性淋巴母細(xì)胞白血病(T-ALL)中。T-ALL是 一種少見的致命性小兒白血病,其特征為未成熟白細(xì)胞大量表達(dá)。
在新研究中,科學(xué)家首先將突變的 Fbxw7 導(dǎo)入到了小鼠健康的血液干細(xì)胞中。研究人員本以為突變會誘導(dǎo)貧血,就如 Fbxw7 缺失時一樣。然而讓研究人員感到驚訝地是,什么事情也沒有發(fā)生——干細(xì)胞繼續(xù)生成血細(xì)胞。
而當(dāng)研究人員隨后將突變 Fbxw7 導(dǎo)入到小鼠的白血病血液干細(xì)胞(那些生成過量白細(xì)胞引起白血病的細(xì)胞)中時,癌癥速度加快。換言之,突變使得白血病干細(xì)胞變得更具侵襲性。
在接下來的實驗中,研究人員證實 Fbxw7 結(jié)合并降解了推動白血病干細(xì)胞的 Myc 蛋白。長期以來 Myc 被認(rèn)為與許多其他的癌癥以及治療后的癌癥復(fù)發(fā)相關(guān)。他們發(fā)現(xiàn),當(dāng) Fbxw7 突變時, Myc 不再受到抑制,癌癥干細(xì)胞群增長。這一認(rèn)識還有助于解釋健康血液干細(xì)胞似乎“忽視”突變 Fbxw7 的原因。不同于白血病干細(xì)胞,健康血液干細(xì)胞通常處于靜止?fàn)顟B(tài),直至機(jī)體需要緊急供血時才會被激活,且它們很少表達(dá) Myc 。
研究人員表示,由于未進(jìn)入細(xì)胞周期,正常血液干細(xì)胞表達(dá)極少的 Myc 。突變不會影響不存在的物質(zhì)。而白血病干細(xì)胞表達(dá) Myc , Fbxw7 突變提高了它的豐度。
隨后研究人員提出,消除 Myc 是否有可能阻止白血病。事實上,在白血病小鼠中敲除 Myc 基因可以耗盡白血病干細(xì)胞,終止腫瘤生長。他們利用阻斷 Myc 的一類新癌癥藥物—— BET 抑制劑,處理小鼠和人類細(xì)胞以及T-ALL的骨髓樣本時獲得了相同的結(jié)果。
研究人員指出, BET 抑制劑確實能夠殺死白血病干細(xì)胞。沒有干細(xì)胞,白血病根本無法生長。而利用 BET 抑制劑可靶向治療小兒和成人T-ALL白血病。


